 右の装置を用いて蒸留を行う。
右の装置を用いて蒸留を行う。蒸留
[原理]
エタノールと水は共沸混合物となるので、蒸留による完全な分離は困難である。
今回は後で用いる反応において水の存在は問題にならないので、4.5%水-エタノールの共沸混合沸点78℃で留出物を集める。
[操作]
エタノール100mLを常圧蒸留する。
[蒸留の原理]
液体を加熱して沸騰させ、発生した蒸気を冷却すると再びもとの液体の状態に戻る。
揮発性の物質は一定の圧力下では一定の沸点を示すので、沸点の差を利用し分離精製することができる。
この操作を蒸留と呼び、液体物質の分離精製に広く用いられる。
常圧蒸留
 右の装置を用いて蒸留を行う。
右の装置を用いて蒸留を行う。
液体の混合物には組成に応じた沸点と凝縮点の差がある。ある組成の混合液体はその組成に対応する沸点で沸騰するが、その際の気相の組成はRaoultの法則により各成分の蒸気圧が反映されるので液相の組成と異なる。これを利用したのが分別蒸留であり気化-液化という操作を繰り返すことにより、純粋な液体に分離精製することが可能である。
分留搭を用いることにより、気化した蒸気は分留間管を上昇する間に、気化-液化を繰り返し分離されるので、単蒸留の繰り返しに相当する操作を簡便に行って効率的な分留を行うことができる。
水とエタノールの混合物の場合、共沸混合物と呼ばれ、ある特定の組成の混合物がその他の成分よりも高沸点または低沸点で沸騰する。水-エタノールの場合、ある特定の組成で沸点が極小値をとり、蒸留操作で出てくる液体は少しその組成に近づいたものが出てくる。
[実験操作]
蒸留するエタノールの重さを計るのにナスフラスコに入れて量るため、最初にナスフラスコ100mlの質量を電子上皿天秤で量った。その質量は76.56gであった。
エタノール100mlを計るのに、500mlメスシリンダーにエタノールを注ぎ量った。その後、体積を正確に量るため100ml、メスシリンダーに移したところ95mlであった。
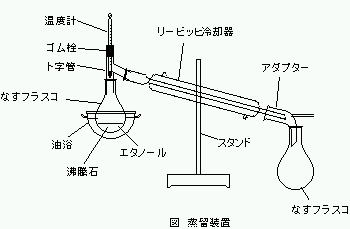
ロートで200mlナスフラスコにエタノールを移し、沸石を入れ、図のような装置を組み立てた。
ゴム栓としてコルクにコルクボーラーで穴を開けたものを用いた。
リービッヒ冷却器に水を流し、吸引アダプターには50ml、100mlナスフラスコをつなぎジョイントで固定した。
リービッヒ冷却器自体はゴムを2本つなげたもので固定した。
温度計の値が一定値を示すまでは蒸留した液体を50mlナスフラスコに入れ、温度が一定になった後は100mlナスフラスコに入れた。
この際、油を時々温度計でかき混ぜた。
経過は以下の通りである。
50℃ 変化なし。
60℃ 液体がナスフラスコに溜まり始めた。
70℃ 液体が溜まり続けていた。
71℃ ここで温度計の値の変化がかなりゆっくりになった。
72.5℃ ここで100mlナスフラスコに切り替えた。
73℃ 非常にゆっくりだが温度計の値は上昇していた。
エタノールをナスフラスコに移し、栓(22.60g)、コルペン台(18.41g)と一緒に質量を測定したところ176.98gであった。
よってエタノールの質量は59.41gである。
[考察]
温度計の値とエタノールの実際の温度には誤差が生じる。
その理由は空気の温度の初期値が常温に等しいことと、エタノールが蒸発し温度計の高さまで移動する間に、蒸気の温度が下がっていくからである。
共沸混合沸点が78℃であるにもかかわらず、約71℃で温度計の値がほとんど一定になったのはこのためであると考えられる。
またその後も温度計の値がゆっくりだが上昇し続けたのは、水-エタノールの共沸混合物としての性質により蒸気に含まれる水の割合が液体に含まれる水の割合よりも低くなっているため、残っている液体は水の割合が多くなり、混合物の沸点が上昇していったことが原因であると思われる。
◇何故蒸気の組成は低沸点物質が多くなるのか?
x:溶液のモル分率 p:蒸気圧
y:蒸気のモル分率 p*:飽和蒸気圧
AがBよりも低沸点(pA*>pB*)とする。
ラウールの法則より
pA=xApA*
pB=xBpB*
ドルトンの法則より
yA=pA/ptotal
yB=pB/ptotal
ptotal=pA+pB
このとき yA-xAの符号は
yA-xA=pA/pA*(pA+pB){pA*-ptotal}
よりpA*-ptotalの符号を考えればよく、
=(1-xA)pA*-xBpB*
=xB(pA*-pB*) > 0
よって低沸点物質Aの蒸気のモル分率が高くなっていることが示された。
| SEO | [PR] 爆速!無料ブログ 無料ホームページ開設 無料ライブ放送 | ||
